リンパ球性下垂体炎(lymphocytic hypophysitis)とは、体の免疫システムが誤って下垂体を攻撃してしまう自己免疫性疾患です。
特に妊娠後期から産後の女性に多く見られ、下垂体に炎症が生じることで、内分泌器官の機能が徐々に低下していきます。
下垂体は成長ホルモンや甲状腺刺激ホルモンなど、私たちの体に必要不可欠な様々なホルモンを分泌する器官であるため、複数のホルモンバランスが乱れ、全身に影響を及ぼすことがあります。
リンパ球性下垂体炎の症状
リンパ球性下垂体炎は下垂体前葉および後葉に炎症が生じることで複数のホルモン分泌異常を引き起こし頭痛や視野障害などの多彩な症状が現れます。
主要な症状と発症パターン
内分泌系の症状は緩やかに進行しながら全身に影響を及ぼしていくため初期の段階では気付きにくいですが、次第に疲労感や倦怠感といった非特異的な症状から始まり徐々にはっきりとした症状へと進展していきます。
ホルモンバランスの乱れは体調の変化だけでなく精神面にも影響を及ぼすことがあり集中力の低下やうつ状態などの精神症状を引き起こすこともあるため包括的な症状の評価が必要です。
| ホルモンの種類 | 欠乏時の主な症状 | 日常生活への影響 |
|---|---|---|
| 副腎皮質刺激ホルモン | 全身倦怠感食欲不振低血圧 | 日中の活動制限体力低下 |
| 甲状腺刺激ホルモン | 寒がりむくみ便秘 | 代謝低下体重増加 |
| 性腺刺激ホルモン | 無月経性欲低下不妊 | 生殖機能低下 |
| 成長ホルモン | 体力低下筋力低下脂質代謝異常 | 疲労感増加回復力低下 |
局所症状と視機能への影響
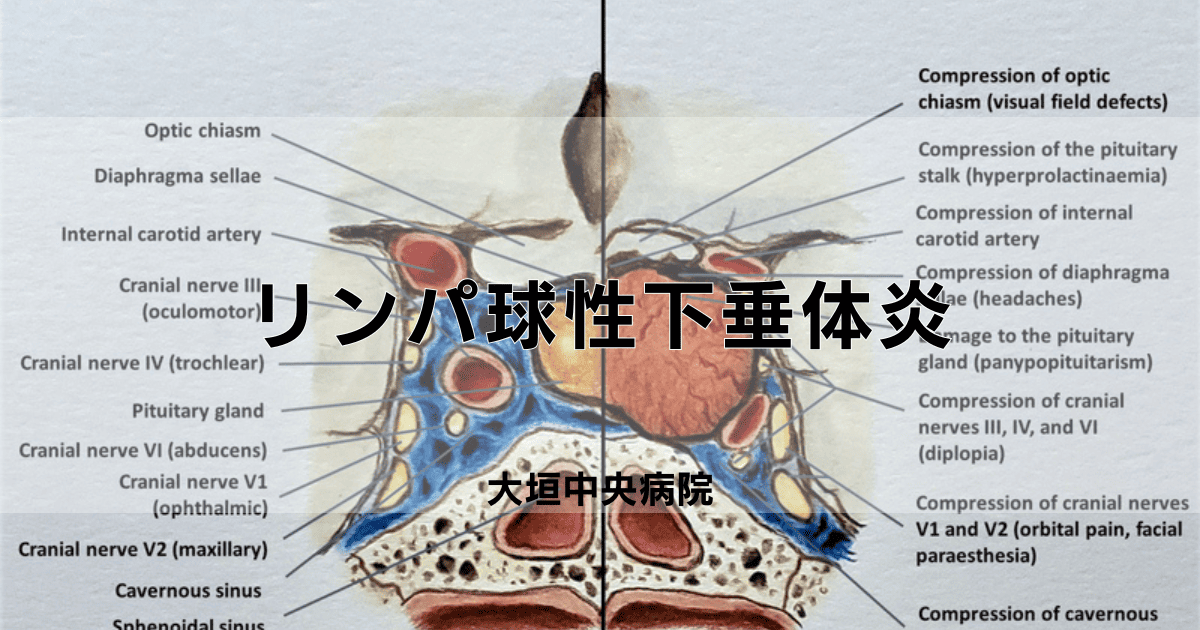
下垂体の炎症による腫大は周辺の重要な神経組織や血管に圧迫を加えることで様々な局所症状を起こすことになり、特に視神経への影響が重要な問題です。
下垂体は視神経交叉の直下に位置しているため上方への腫大が進むと視神経を圧迫し視野障害や視力低下などの深刻な症状が現れます。
頭痛は最も一般的な局所症状の一つであり約70%の患者さんが経験し、持続的で鈍い痛みが特徴的で日常生活に支障をきたすことも少なくありません。
視機能障害は初期には気付きにくい場合もありますが、徐々に進行していく傾向があり両耳側の視野が欠けていくため、定期的な視野検査による経過観察が重要です。
頭痛の性質は、拍動性の痛みを感じる方もいれば持続的な圧迫感として感じる方もおり痛みの強さも様々ですが、多くの場合朝方に強く夕方にかけて和らぎます。
内分泌機能低下による二次的症状
下垂体前葉から分泌される各種ホルモンの低下はそれぞれ標的となる内分泌器官の機能低下を起こし、M二次的な症状を生じさせます。
- 甲状腺機能低下による基礎代謝の低下と体重増加 体温調節機能の低下や疲労感の増加。
- 副腎皮質機能不全によるストレス耐性の低下 感染症などの身体的ストレスに弱くなる。
- 性腺機能低下による性的特徴の喪失 女性では無月経や乳汁分泌不全男性では性欲低下などが起こる。
- 成長ホルモン分泌不全 体組成の変化や脂質代謝異常が生じやすくなくなる。
| 二次的症状の分類 | 主な症状 | 生活への影響度 | 発現時期 |
|---|---|---|---|
| 代謝性症状 | 体重変動むくみ | 中程度 | 比較的早期 |
| 自律神経症状 | 低血圧めまい | 高度 | 進行期 |
| 精神神経症状 | 不眠抑うつ | 中程度 | 様々 |
| 免疫機能低下 | 感染しやすさ | 高度 | 進行期 |
特殊な病態と注意すべき症状
下垂体後葉機能不全による尿崩症は本疾患における特徴的な合併症の一つです。
尿崩症を発症すると抗利尿ホルモンの分泌低下により一日に数リットルにも及ぶ大量の希釈尿の排出と、それに伴う強い口渇感が出現し特に夜間の頻尿により睡眠が妨げられることで日中の活動にも支障をきたすようになります。
妊娠期に発症した場合は特に慎重な経過観察が不可欠で、分娩時の出血や産褥期のショックなどの重篤な合併症のリスクが上昇するため専門医による継続的な管理が必要です。
また、下垂体機能低下症による副腎不全は感染症やストレスなどを契機に急性増悪することがあり、意識障害や循環不全などの生命を脅かす症状を起こす場合があるため早期の症状認識と対応が求められます。
リンパ球性下垂体炎の原因
リンパ球性下垂体炎の主たる原因は、体を守るはずの免疫システムが誤って下垂体を攻撃してしまう自己免疫反応で、下垂体組織への免疫細胞の浸潤と持続的な炎症反応が引き起こされます。
免疫システムの異常と自己抗体の役割
自己免疫疾患としてのリンパ球性下垂体炎の発症メカニズムにおいて、最も重要な役割を果たしているのが、体内の免疫システムによる下垂体組織の誤認識とそれに続く免疫応答の連鎖反応です。
この過程では外敵から体を守るはずの免疫細胞が、何らかのきっかけで下垂体を異物として認識してしまい、攻撃を開始することで炎症が起きます。
免疫応答の過程で産生される様々な自己抗体の存在で、下垂体特異的な抗原であるα-エノラーゼやGFAPなどに対する自己抗体が同定され、病態の進行に深く関与していることが明らかになってきました。
免疫細胞の中でも特にリンパ球と呼ばれる細胞が下垂体組織に浸潤することで持続的な炎症反応が起こり、下垂体前葉を中心とした組織損傷が徐々に進行していくことが分かっています。
| 自己抗体の種類 | 標的となる抗原 |
|---|---|
| 抗α-エノラーゼ抗体 | α-エノラーゼ |
| 抗GFAP抗体 | グリア線維性酸性タンパク質 |
| 抗下垂体細胞質抗体 | 下垂体細胞質成分 |
妊娠・出産との関連性
リンパ球性下垂体炎と妊娠・出産との関連性については、妊娠後期から産後にかけての発症頻度の顕著な上昇が報告されています。
背景には、妊娠期における母体の免疫システムの劇的な変化があり、胎児を受け入れるために一時的に抑制状態となった免疫機能が、出産を機に急速に活性化される過程で、予期せぬ自己免疫反応が誘発されることが分かってきました。
さらに、妊娠中は下垂体前葉のプロラクチン産生細胞が著しく増加し、下垂体自体のサイズも最大150%まで肥大することがあり、このような生理的変化そのものが免疫システムの標的となりやすい状況を作り出しているのです。
遺伝的要因と環境因子
遺伝的背景に関する研究からは、特定のHLA(ヒト白血球抗原)タイプを持つ個人において発症リスクが有意に上昇することが明らかです。
関連するHLAタイプは、免疫システムにおける自己と非自己の認識に深く関与しており、自己免疫反応の起こりやすさに影響を与えます。
| HLAタイプ | リスク上昇率 |
|---|---|
| DQ8-DR3 | 2.5倍 |
| DR4 | 1.8倍 |
| DQ2 | 1.6倍 |
環境因子による影響
- ウイルス感染による免疫系の活性化と交差反応の惹起
- 慢性的なストレス暴露による免疫調節機構の破綻
- 環境中の内分泌撹乱物質への持続的な曝露
- 腸内細菌叢の多様性低下による免疫バランスの変調
他の自己免疫疾患との関連
自己免疫性甲状腺疾患や1型糖尿病は高い併存率があり、疾患に共通する免疫学的メカニズムの存在が強く示唆されています。
全身性の自己免疫疾患を有する患者群においては、下垂体に対する自己抗体が検出される頻度が一般集団と比べて明らかに高く、このことは複数の自己免疫疾患が同時に、あるいは段階的に発症するリスクが存在することを示しています。
リンパ球性下垂体炎の検査・チェック方法
リンパ球性下垂体炎の診断では、血液検査による詳細なホルモン分泌動態の評価、高解像度MRIを用いた下垂体の詳細な画像診断、さらに特異的な自己抗体の検出を組み合わせた包括的なアプローチを行うことで、より確実な診断へとつながります。
血液検査による内分泌機能評価
下垂体から分泌される各種ホルモンの血中濃度測定は、診断において最も基本となる検査であり、病態の進行度や重症度を判断する上で極めて重要な指標です。
朝食前の空腹時に採血を行い、下垂体前葉から分泌される主要なホルモンの基礎値を測定することで、どの程度の機能低下が生じているのかを詳細に評価することができます。
| ホルモン検査項目 | 評価対象 |
|---|---|
| ACTH | 副腎皮質刺激ホルモン |
| TSH | 甲状腺刺激ホルモン |
| GH | 成長ホルモン |
| PRL | プロラクチン |
| LH/FSH | 性腺刺激ホルモン |
ホルモン基礎値の測定に加えて負荷試験を実施することで、下垂体の予備能力をより詳細に評価することができ、特にACTH分泌不全が疑われる場合には、副腎不全の予防という観点からも迅速な評価が不可欠です。
画像診断による形態評価
MRI検査は、下垂体の形態学的変化を鮮明に描出できる最も有用な画像診断法で、ガドリニウム造影剤を用いた造影MRI検査では、炎症による特徴的な造影パターンの変化や下垂体柄の肥厚といった重要な所見を詳細に観察できます。
T1強調画像では下垂体実質の信号強度の変化を、T2強調画像では浮腫性変化の有無を評価でき、所見を総合的に判断することで、炎症の活動性や進展度を正確に把握することが可能です。
造影MRI検査では、炎症性変化を反映して下垂体全体が均一に造影される特徴的なパターンが観察され、下垂体腺腫などの腫瘍性病変との鑑別において特に有用な情報となります。
| MRI所見の特徴 | 臨床的意義 |
|---|---|
| 均一な造影効果 | 活動性炎症 |
| 下垂体柄の肥厚 | 炎症の進展 |
| Empty sella | 慢性期変化 |
| 限局性腫大 | 腫瘍との鑑別 |
自己抗体検査と免疫学的評価
リンパ球性下垂体炎の診断における免疫学的評価として下垂体特異的な自己抗体の検出が実施され、診断をより確実なものとする補助的な検査として位置づけられています。
主な検査対象となる自己抗体
- 抗下垂体細胞質抗体
- 抗α-エノラーゼ抗体
- 抗GFAP抗体
- 抗PIT-1抗体
自己抗体の存在は、免疫学的な異常が背景にあることを示す重要な指標となり、特に妊娠・出産に関連した発症例では、自己抗体が高頻度に検出されます。
また、他の自己免疫疾患の合併の有無を評価するため、甲状腺自己抗体や膵島関連自己抗体などの測定も併せて実施されることが多いです。
鑑別診断のための追加検査
下垂体腫瘍や他の炎症性疾患との鑑別を確実に行うため、追加検査が実施され、それぞれの検査結果を総合的に判断することで、より正確な診断へとつながっていきます。
視野検査は、下垂体の腫大による視交叉への圧迫の有無を評価する上で必須の検査で、上方への視野欠損が認められた場合には、速やかな対応が必要です。
髄液検査は中枢神経系の他の炎症性疾患との鑑別に有用な情報を提供し、IgG4関連下垂体炎や肉芽腫性下垂体炎との鑑別において重要な役割を果たします。
リンパ球性下垂体炎の治療方法と治療薬、治療期間
リンパ球性下垂体炎の治療は炎症を抑制するための免疫抑制療法とホルモン補充療法を組み合わせて行い、治療期間は数か月から数年に及ぶ慢性的な経過をたどることが多いです。
免疫抑制療法による炎症制御
免疫抑制療法は下垂体の炎症を抑制することで疾患の進行を防ぎ、既存の下垂体機能を保持することを目的として実施されており副腎皮質ステロイド薬による治療が第一選択です。
副腎皮質ステロイド薬による治療ではプレドニゾロンを高用量で開始し、症状の改善に応じて徐々に減量していく方法が採用されており、初期投与量は通常30から40mgで開始されます。
免疫抑制療法の治療期間は炎症の程度や症状の改善状況によって個人差が大きく数か月で終了する例がある一方で数年以上の長期投与が必要となるケースもあり定期的な評価と用量調整が不可欠です。
副腎皮質ステロイド薬による治療で十分な効果が得られない際には、他の免疫抑制薬との併用や生物学的製剤の使用も検討します。
| 免疫抑制薬の種類 | 投与量の目安 | 主な副作用 | 投与期間 |
|---|---|---|---|
| プレドニゾロン | 30-40mg/日 | 満月様顔貌骨粗鬆症 | 数か月から数年 |
| アザチオプリン | 50-100mg/日 | 骨髄抑制肝機能障害 | 半年から数年 |
| シクロスポリン | 3-5mg/kg/日 | 腎機能障害高血圧 | 半年から数年 |
| リツキシマブ | 375mg/㎡/週 | 感染症アレルギー | 4週間程度 |
ホルモン補充療法による内分泌機能の維持
ホルモン補充療法は下垂体機能低下に伴う各種ホルモンの欠乏を補うために実施される基本的な治療で、生命維持に直結する重要なホルモンから優先的に補充を開始します。
副腎皮質ホルモンの補充は生命維持に最も重要であることから最優先で開始される治療であり、通常ヒドロコルチゾンが使用され、投与量は朝15mg夕5mgを基本として患者さんの状態に応じて調整します。
甲状腺ホルモン補充は代謝機能の維持に必要不治療で、レボチロキシンナトリウムが使用され、投与量は体重あたり1.6μg/kgを目安です。
性腺機能低下に対するホルモン補充は年齢や症状に応じて実施し、女性ではエストロゲンとプロゲステロンの併用男性ではテストステロン製剤を使用します。
| ホルモン補充の種類 | 使用薬剤 | 投与タイミング | 補充期間 |
|---|---|---|---|
| 副腎皮質ホルモン | ヒドロコルチゾン | 朝夕分割投与 | 永続的 |
| 甲状腺ホルモン | レボチロキシン | 朝1回投与 | 永続的 |
| 性腺ホルモン | エストロゲン類 | 周期的投与 | 症状に応じて |
| 成長ホルモン | ソマトロピン | 就寝前投与 | 状態により判断 |
治療効果の評価と経過観察
下垂体機能の回復は個人差が大きく投与量や治療期間は、いろいろな要素に基づいて慎重に判断します。
- 画像検査による下垂体の腫大や炎症の程度の評価
- 血中ホルモン値の定期的なモニタリング
- 臨床症状の改善度合いの確認
- 副作用の出現状況の観察
薬の副作用や治療のデメリットについて
リンパ球性下垂体炎の治療では免疫抑制薬による長期投与に伴う感染リスクの上昇や骨粗鬆症などの身体的な副作用に加えホルモン補充療法による体重増加や血圧上昇などの代謝性の問題が生じます。
ステロイド療法に伴う副作用
副腎皮質ステロイド薬による免疫抑制療法は基本的な治療法として広く用いられているものの、長期投与に伴う様々な副作用への対応が重要な課題となっています。
高用量のステロイド投与は免疫機能を抑制することから感染症のリスクが増大し、呼吸器感染症や皮膚感染症などの日和見感染に対する注意深い観察が必要です。
骨粗鬆症はステロイド療法における代表的な副作用の一つで、骨密度の低下に伴う骨折リスクの上昇が認められることから定期的な骨密度測定による評価が求められます。
| 副作用の種類 | 発現頻度 | 予防対策 | モニタリング項目 |
|---|---|---|---|
| 骨粗鬆症 | 高頻度 | カルシウム製剤 | 骨密度測定 |
| 感染症 | 中等度 | 予防投薬 | 体温血液検査 |
| 消化性潰瘍 | 中等度 | 胃粘膜保護薬 | 消化器症状 |
| 高血圧 | 高頻度 | 減塩指導 | 血圧測定 |
ホルモン補充療法による代謝性の問題
ホルモン補充療法は各種ホルモンの相互作用による複雑な代謝変化をもたらすことから、綿密な用量調整が大切です。
甲状腺ホルモン補充療法では過剰投与による頻脈や発汗過多などの症状が出現する可能性があり、高齢者では心血管系への負担に注意を払う必要があります。
性腺ホルモン補充療法では、女性におけるエストロゲン投与に伴う血栓症のリスク上昇や、男性におけるテストステロン補充による前立腺への影響などが懸念されることから定期的な評価が重要です。
免疫抑制療法の長期的な影響
免疫抑制療法には、長期的な健康課題をもたらす要因がいくつかあります。
| 長期合併症 | リスク因子 | 早期発見のポイント | 予防的介入 |
|---|---|---|---|
| 骨粗鬆症性骨折 | 高齢女性喫煙 | 定期的骨密度測定 | ビタミンD投与 |
| 無菌性骨壊死 | 高用量ステロイド | MRI検査 | 負荷軽減 |
| 動脈硬化症 | 高血圧脂質異常 | 血管エコー | 生活習慣改善 |
| ステロイド糖尿病 | 肥満家族歴 | 血糖値モニタリング | 食事運動療法 |
保険適用と治療費
以下に記載している治療費(医療費)は目安であり、実際の費用は症状や治療内容、保険適用否により大幅に上回ることがございます。当院では料金に関する以下説明の不備や相違について、一切の責任を負いかねますので、予めご了承ください。
保険診療における基本検査と診断費用
内分泌疾患の診断には複数の血液検査が必要となり、下垂体から分泌される各種ホルモンの測定を行い、画像検査も必要です。
| 検査項目 | 保険適用後の自己負担額(3割負担の場合) |
|---|---|
| 基本的な血液検査 | 2,000~3,000円 |
| 内分泌負荷試験 | 5,000~8,000円 |
| 造影MRI検査 | 15,000~20,000円 |
| 自己抗体検査 | 3,000~5,000円 |
薬物療法にかかる費用
免疫抑制薬による治療を行う際の薬剤費は使用する薬剤の種類や投与量によって異なり、免疫抑制剤を併用する場合は、薬剤費が追加で必要です。
| 治療薬 | 1ヶ月あたりの自己負担額(3割負担の場合) |
|---|---|
| ステロイド薬 | 2,000~5,000円 |
| 免疫抑制剤 | 8,000~15,000円 |
| ホルモン補充薬 | 3,000~10,000円 |
以上
参考文献
Molitch ME, Gillam MP. Lymphocytic hypophysitis. Hormone research. 2007 Dec 1;68(Suppl. 5):145-50.
Bellastella A, Bizzarro A, Coronella C, Bellastella G, Sinisi AA, De Bellis A. Lymphocytic hypophysitis: a rare or underestimated disease?. European Journal of Endocrinology. 2003 Nov;149(5):363-76.
Cosman F, Post KD, Holub DA, Wardlaw SL. Lymphocytic hypophysitis. Report of 3 new cases and review of the literature. Medicine. 1989 Jul 1;68(4):240.
Rivera JA. Lymphocytic hypophysitis: disease spectrum and approach to diagnosis and therapy. Pituitary. 2006 Mar;9:35-45.
Thodou EL, Asa SL, Kontogeorgos GE, Kovacs KA, Horvath E, Ezzat SH. Clinical case seminar: lymphocytic hypophysitis: clinicopathological findings. The Journal of Clinical Endocrinology & Metabolism. 1995 Aug 1;80(8):2302-11.
Takao T, Nanamiya W, Matsumoto R, Asaba K, Okabayashi T, Hashimoto K. Antipituitary antibodies in patients with lymphocytic hypophysitis. Hormone Research in Paediatrics. 2001 Jan 18;55(6):288-92.
Crock PA. Cytosolic autoantigens in lymphocytic hypophysitis. The Journal of Clinical Endocrinology & Metabolism. 1998 Feb 1;83(2):609-18.
Kyriacou A, Gnanalingham K, Kearney T. Lymphocytic hypophysitis: modern day management with limited role for surgery. Pituitary. 2017 Apr;20:241-50.
GUAY AT, AGNELLO V, TRONIC BC, GRESHAM DG, FREIDBERG SR. Lymphocytic hypophysitis in a man. The Journal of Clinical Endocrinology & Metabolism. 1987 Mar 1;64(3):631-4.
Ng WH, Gonzales M, Kaye AH. Lymphocytic hypophysitis. Journal of clinical neuroscience. 2003 Jul 1;10(4):409-13.