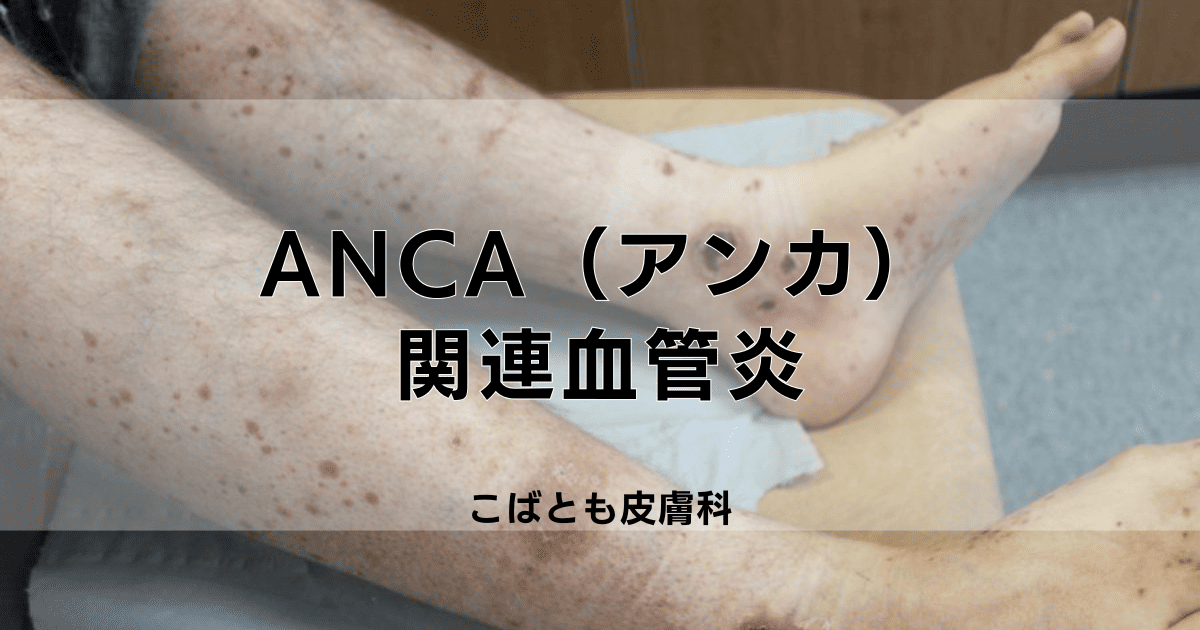
ANCA(アンカ)関連血管炎(ANCA-associated vasculitis)とは、血液中に出現する特殊な自己抗体(ANCA)が引き起こす自己免疫疾患です。
全身の血管、特に細小血管から中型血管に炎症が生じ、腎臓、肺、皮膚、神経など多岐にわたる臓器に炎症が波及し、患者さんごとに異なる多彩な症状を呈します。
この記事の執筆者

小林 智子(こばやし ともこ)
日本皮膚科学会認定皮膚科専門医・医学博士
こばとも皮膚科院長
2010年に日本医科大学卒業後、名古屋大学医学部皮膚科入局。同大学大学院博士課程修了後、アメリカノースウェスタン大学にて、ポストマスターフェローとして臨床研究に従事。帰国後、同志社大学生命医科学部アンチエイジングリサーチセンターにて、糖化と肌について研究を行う。専門は一般皮膚科、アレルギー、抗加齢、美容皮膚科。雑誌を中心にメディアにも多数出演。著書に『皮膚科医が実践している 極上肌のつくり方』(彩図社)など。
こばとも皮膚科関連医療機関
ANCA(アンカ)関連血管炎の病型
ANCA関連血管炎は、主に顕微鏡的多発血管炎(MPA)、多発血管炎性肉芽腫症(GPA)、好酸球性多発血管炎性肉芽腫症(EGPA)の3つの病型に分類されています。
病型分類の概要
ANCA関連血管炎の3つの病型は、それぞれ特有の臨床症状や検査所見、血管炎の分布パターン、予後などが異なることから、診断時における正確な病型分類が極めて重要です。
病型は、2012年に改訂された国際チャペルヒル会議血管炎命名法(CHCC2012)において、現在の名称に統一されることとなり、世界的に標準化された疾患概念として確立しています。
各病型の分類は、血管炎の主たる標的となる血管のサイズ、血管炎の分布パターン、特徴的な組織所見、そして自己抗体の種類などの要素を総合的に評価することで決定します。
| 病型 | 主なANCA | 好発年齢 | 男女比 |
|---|---|---|---|
| MPA | MPO-ANCA | 60-70歳代 | 1:1.1 |
| GPA | PR3-ANCA | 50-60歳代 | 1:1 |
| EGPA | MPO-ANCA/陰性 | 40-50歳代 | 1:1.2 |
病型分類において特筆すべき点は、日本と欧米では各病型の頻度分布が大きく異なることです。
日本ではMPAが最も多く、次いでGPA、EGPAの順となっていますが、欧米ではGPAが最も多く報告されており、この違いには遺伝的背景や環境因子が関与している可能性が指摘されています。
顕微鏡的多発血管炎(MPA)の特徴
顕微鏡的多発血管炎は、主に小型血管を標的とする血管炎であり、日本人に最も多くみられる病型として知られており、特に高齢者での発症が特徴的です。
MPAでは、血清中のMPO-ANCAが90%以上の症例で陽性となり、腎臓や肺における血管炎症状が特徴的な所見として認められ、早期診断のための重要なマーカーとして活用されています。
この病型における血管炎は、肉芽腫性炎症を伴わない壊死性血管炎として現れ、組織学的には細小動脈、毛細血管、細小静脈などの小型血管に炎症性変化が生じ、腎臓では糸球体係蹄壁の壊死性変化や半月体形成が起こります。
MPAの臨床経過は、他の血管炎と比較して急速に進行する傾向があり、急速進行性糸球体腎炎や肺胞出血などの重篤な病態を引き起こす可能性が高いです。
多発血管炎性肉芽腫症(GPA)の病態
GPAは、以前はウェゲナー肉芽腫症として知られていた疾患で、上気道や肺、腎臓に好発する肉芽腫性炎症を特徴とする血管炎であり、他の血管炎との鑑別が比較的容易な病型です。
この病型では、PR3-ANCAが80%以上の症例で陽性となり、肉芽腫性炎症が上気道や肺に形成され、上気道病変は鼻中隔穿孔や鞍鼻などを起こし、所見は診断の重要な手がかりとなります。
肺病変については、結節性病変や空洞形成が特徴的であり、これらの画像所見は他の血管炎との鑑別点として重要な意味を持っています。
| 病型特徴 | 主な血管病変 | 特徴的な所見 | 予後規定因子 |
|---|---|---|---|
| MPA | 小型血管炎 | 壊死性糸球体腎炎 | 腎機能障害 |
| GPA | 小~中型血管炎 | 肉芽腫性炎症 | 上気道病変 |
| EGPA | 小型血管炎 | 好酸球性炎症 | 心筋障害 |
好酸球性多発血管炎性肉芽腫症(EGPA)の特性
EGPAは、以前はチャーグ・ストラウス症候群と呼ばれていた疾患であり、末梢血中の好酸球増多と気管支喘息の既往が特徴的な所見として認められ、他の血管炎とは異なる独特の臨床経過をたどることが知られています。
この病型の発症には、気管支喘息の既往が先行し、血管炎症状の出現までに平均5-10年程度の喘息期間が存在することが報告されています。
EGPAでは、約40%の症例でMPO-ANCAが陽性となりますが、他の病型と比較してANCA陰性例も多く認められ、このANCA陽性例と陰性例では臨床像が異なります。
好酸球性炎症は、末梢血好酸球数が1,500/μL以上に増加することが診断基準の一つとなっており、組織における好酸球浸潤も特徴的な所見です。
心臓病変は、EGPAにおける最も重要な因子で、心筋炎や冠動脈炎などの心血管病変の存在は、生命予後に大きな影響を与えます。
ANCA(アンカ)関連血管炎の症状
ANCA関連血管炎は、全身の血管に炎症が起こり、発熱や倦怠感などの全身症状から、肺や腎臓などの重要な臓器にまで多彩な症状が現れます。
全身に現れる初期症状について
全身性の症状は、ANCA関連血管炎の発症初期から見られることが多く、38度以上の発熱が数週間以上持続することや、原因不明の体重減少、全身の倦怠感などが特徴的な症状として挙げられ、症状は徐々に進行します。
これらの症状に加えて、関節痛や筋肉痛といった運動器の症状も多くの患者さんに見られ、特に朝方に症状が強くなる傾向があることから、日常生活動作に支障をきたすことが多いです。
| 全身症状 | 症状の特徴 |
|---|---|
| 発熱 | 38度以上が持続 |
| 倦怠感 | 全身の強い疲労感 |
| 体重減少 | 短期間での減少 |
| 食欲不振 | 持続的な食欲低下 |
呼吸器系の症状と特徴
呼吸器系の症状は、ANCA関連血管炎において最も注意が必要な症状の一つで、咳や痰、息切れといった症状から始まることが多く、症状は運動時や夜間に悪化します。
症状が進行すると、肺胞出血という状態に至ることがあり、この状態では血痰を伴う咳や、急激な呼吸困難感が出現することがあるため、症状が見られた際には速やかに専門医への相談してください。
- 持続する咳嗽
- 血痰の出現
- 呼吸困難
- 胸痛
- 喘鳴音
腎臓の症状と進行
腎臓の症状は、初期には自覚症状に乏しいことが多いものの、急速進行性糸球体腎炎という形で進行し、尿検査での異常所見は早期発見につながる大切な手がかりです。
症状が進行すると、むくみや高血圧、さらには腎機能の低下による尿毒症症状が出じることもあり、下肢のむくみや、朝方の顔面のむくみ、夜間頻尿などの症状は、腎機能障害の進行を示唆します。
| 腎症状 | 特徴的な所見 |
|---|---|
| 血尿 | 肉眼的または顕微鏡的 |
| 蛋白尿 | 持続的な蛋白漏出 |
| むくみ | 下肢優位の浮腫 |
| 高血圧 | 継続的な血圧上昇 |
皮膚・神経系などの多彩な症状
皮膚症状としては、紫斑や皮下結節、潰瘍などが体の様々な部位に現れ、症状は血管炎による微小血管の障害を反映していることから、疾患活動性の指標です。
神経系の症状としては、末梢神経障害が特徴的で、手足のしびれや痛み、筋力低下などが左右非対称に起きることが多く、足先から始まって徐々に上行していきます。
消化器症状としては、腹痛や下痢、吐き気などが見られることがあり、これらの症状も血管炎による腸管血管の炎症が原因となっていることから、症状の持続期間や程度によっては緊急の対応が必要となる場合もあります。
眼症状としては、結膜炎や強膜炎、ぶどう膜炎などの炎症性の症状が現れることがあり、視力低下を起こす可能性があることから、定期的な眼科検査による経過観察も推奨されています。
- 皮膚の紫斑や潰瘍
- 手足のしびれ感
- 腹部症状
- 眼の充血や視力低下
- 副鼻腔炎症状
ANCA(アンカ)関連血管炎の原因
ANCA関連血管炎は、体内で産生される自己抗体であるANCA(抗好中球細胞質抗体)が引き起こす自己免疫疾患で、遺伝的要因と環境因子の複雑な相互作用によって発症します。
免疫システムの異常と自己抗体について
免疫システムの異常は、ANCA関連血管炎の発症メカニズムの中核を担っており、好中球に対する自己抗体であるANCAの産生が、血管壁の炎症を起こす直接的な原因となっていることが多いです。
通常の免疫システムでは、体内に侵入した病原体を認識して攻撃する一方で、自分自身の組織は攻撃しないように制御されていますが、ANCA関連血管炎では、制御機構に異常が生じ、自己の組織を誤って攻撃してしまう現象が起こります。
| 自己抗体の種類 | 主な標的抗原 |
|---|---|
| PR3-ANCA | プロテイナーゼ3 |
| MPO-ANCA | ミエロペルオキシダーゼ |
| その他のANCA | エラスターゼなど |
遺伝的要因と体質的な背景
遺伝的要因は、ANCA関連血管炎の発症リスクを高める重要な因子の一つで、特定のHLA(ヒト白血球抗原)型を持つ人々で発症率が高いです。
家族歴のある患者さんでは特定の遺伝子多型を持っており、これらの遺伝子変異は免疫システムの制御に関与していることから、発症メカニズムの解明に向けた研究が進められています。
- HLA-DPB1遺伝子の特定の型
- SERPINA1遺伝子の変異
- PRTN3遺伝子の多型
- CD226遺伝子の変異
- IL-10プロモーター領域の多型
環境因子と外的刺激の影響
環境因子は、遺伝的な素因を持つ人々において疾患の発症を引き起こすきっかけとなることが多く、シリカ粉塵への曝露や、特定の薬剤の使用、感染症の既往などが、発症リスクを高めます。
職業性の粉塵曝露、採石場や建設現場での長期的な粉塵への曝露は、ANCA関連血管炎の発症リスクを著しく上昇させ、これは粉塵が免疫システムを活性化させる原因です。
| 環境因子 | リスク増加の程度 |
|---|---|
| シリカ粉塵 | 高度 |
| 有機溶剤 | 中等度 |
| 重金属 | 中等度 |
| 農薬 | 軽度 |
感染症と免疫反応の関連性
感染症は、ANCA関連血管炎の発症や再燃のきっかけとなることが知られており、上気道感染症や慢性的な副鼻腔炎などの存在が、免疫システムの異常な活性化を起こす要因です。
黄色ブドウ球菌の持続的な鼻腔内保菌は、再発性多発血管炎性肉芽腫症(GPA)の患者さんにおいて高頻度に認められ、この細菌感染が免疫システムを持続的に刺激することで、発症に関与している可能性が指摘されています。
さらに、特定のウイルス感染症が自己免疫反応を誘発することがあることも示唆されており、パルボウイルスB19やサイトメガロウイルスなどの感染が、発症のきっかけとなることが報告されています。
- 上気道感染症
- 慢性副鼻腔炎
- ウイルス感染
- 細菌感染
- 寄生虫感染
ANCA(アンカ)関連血管炎の検査・チェック方法
ANCA関連血管炎の診断には、血液検査によるANCA抗体の測定を中心に、身体所見、画像検査、および生検による病理組織検査などを組み合わせた総合的な評価が重要です。
基本的な検査の進め方
血管炎を疑う症状が出現した際には、まず問診による詳細な病歴聴取と身体診察から始まり、その後に各種血液検査や画像検査へと進んでいきます。
初期評価における血液検査では、炎症反応を示すCRPやESRの上昇、貧血の有無、腎機能や肝機能などの一般的な検査項目に加えて、ANCA抗体の測定を行うことが必要です。
| 検査項目 | 主な異常所見 | 診断的意義 |
|---|---|---|
| CRP・ESR | 上昇 | 炎症の存在 |
| 血算 | 貧血・血小板減少 | 疾患活動性 |
| 腎機能 | Cr上昇・eGFR低下 | 腎障害評価 |
| ANCA | MPO/PR3-ANCA陽性 | 確定診断 |
血液検査による評価
ANCA抗体の測定には、間接蛍光抗体法(IF法)とELISA法という2つの異なる測定方法があり、それぞれの特徴を活かして総合的に判断することで、より正確な診断が可能です。
IF法では、細胞質型ANCA(C-ANCA)と核周囲型ANCA(P-ANCA)というパターンの違いを観察でき、これらのパターンは病型の推定にも役立つ重要な情報となります。
ELISA法では、より具体的な標的抗原であるMPO-ANCAとPR3-ANCAを定量的に測定することができ、結果は診断確定のみならず、病勢のモニタリングにも有用です。
また、一般的な血液検査では、白血球数、CRP、血沈(ESR)などの炎症マーカーの上昇が認められ、EGPAでは末梢血好酸球の著明な増加が特徴的な所見となります。
画像検査による病変の評価
画像検査は各臓器における血管炎の進展度や範囲を評価する上で不可欠な検査で、胸部レントゲン、CT、MRI、超音波検査などを症状に応じて組み合わせて実施します。
胸部CT検査では、肺胞出血や間質性肺炎、結節性病変などの特徴的な所見を詳細に観察でき、GPAにおける肺病変の評価に役立ちます。
| 画像検査 | 評価対象 | 特徴的所見 |
|---|---|---|
| 胸部CT | 肺病変 | 結節・浸潤影 |
| 頭部MRI | 中枢神経 | 梗塞・出血 |
| 腹部CT | 消化管 | 壁肥厚・虚血 |
| 超音波 | 末梢血管 | 狭窄・閉塞 |
組織生検による確定診断
確定診断のためには組織生検が決定的な役割を果たすことが多く、特に腎生検や皮膚生検は比較的安全に実施できる重要な検査となります。
生検部位の選択は、臨床症状や画像所見を参考に、最も診断に寄与する可能性の高い部位を慎重に検討して決定します。
主な生検検査のポイント
- 腎生検 壊死性糸球体腎炎の確認
- 皮膚生検 白血球破砕性血管炎の証明
- 肺生検 肉芽腫性病変の同定
- 神経生検 血管炎による神経障害の確認
- 筋生検 血管炎の組織学的証明
組織生検では、血管壁の炎症や壊死、肉芽腫形成などの特徴的な病理所見を確認でき、腎生検では、光学顕微鏡、蛍光抗体法、電子顕微鏡による詳細な観察を行い、糸球体病変の性質や程度、活動性の評価を行うことで、より正確な診断と予後予測が可能です。
皮膚生検は比較的低侵襲で実施できる検査で、白血球破砕性血管炎の所見を確認することで、血管炎の存在を直接的に証明できます。
ANCA(アンカ)関連血管炎の治療法と治療薬について
ANCA関連血管炎の治療では、副腎皮質ステロイド薬と免疫抑制薬を組み合わせた寛解導入療法を2~6ヶ月間行い、その後は再発予防のための寛解維持療法を最低2年間継続することが基本です。
寛解導入療法の実際
寛解導入療法は、ANCA関連血管炎の活動性を急速に抑制することを目的とした治療法であり、疾患の重症度に応じて、大量のステロイドパルス療法から開始することが多く、その後、経口ステロイド薬による継続治療へと移行していきます。
重症例では、シクロホスファミドやリツキシマブなどの強力な免疫抑制薬を併用することでより確実な効果が期待でき、特にリツキシマブはB細胞を特異的に抑制することから、有効性が証明されてきました。
免疫抑制薬の選択においては、患者さんの年齢や臓器障害の程度、合併症の有無などを総合的に判断しながら薬剤を選択します。
| 寛解導入薬 | 投与方法 | 特徴 |
|---|---|---|
| メチルプレドニゾロン | 点滴静注 | 即効性が高い |
| シクロホスファミド | 経口または点滴 | 強力な免疫抑制 |
| リツキシマブ | 点滴静注 | B細胞特異的 |
| プレドニゾロン | 経口 | 維持投与に使用 |
寛解維持療法のポイント
寛解維持療法は、疾患の再燃を予防するために不可欠な治療段階であり、アザチオプリンやミコフェノール酸モフェチルなどの免疫抑制薬を、低用量のステロイド薬と組み合わせて長期的に使用します。
維持療法期間中は、定期的な血液検査や尿検査により疾患活動性をモニタリングしながら、免疫抑制薬の投与量を慎重に調整していくことで、長期的な寛解維持が目標です。
- アザチオプリンによる長期維持療法
- ミコフェノール酸モフェチルの計画的投与
- メトトレキサートの週1回定期投与
- リツキシマブの計画的な追加投与
- プレドニゾロンの段階的な用量調整
重症度別の治療戦略
重症度の評価は、治療方針の決定において重要な要素で、肺出血や急速進行性糸球体腎炎などの重篤な臓器障害を伴う場合には、より積極的な治療介入が必要です。
中等症から重症例では、血漿交換療法を追加することで循環血液中の自己抗体を物理的に除去し、より早期の症状改善が期待できることから、肺胞出血を伴う症例で積極的に検討されます。
血漿交換療法は通常週3回程度の頻度で実施され、免疫抑制療法と組み合わせることで、より確実な治療効果を得ることができ、特に重症例における予後の改善に有用です。
| 重症度 | 基本治療 | 追加治療の選択肢 |
|---|---|---|
| 軽症 | 経口ステロイド | 免疫抑制薬の追加 |
| 中等症 | ステロイド+免疫抑制薬 | 生物学的製剤 |
| 重症 | 強力な併用療法 | 血漿交換療法 |
| 最重症 | 集中治療 | 特殊血液浄化療法 |
薬の副作用や治療のデメリットについて
ANCA関連血管炎の治療では、ステロイド薬や免疫抑制薬による感染症リスクの増加、骨粗鬆症、糖尿病などの重大な副作用があります。
ステロイド薬による主な副作用
ステロイド薬は、ANCA関連血管炎の治療において中心的な役割を果たしますが、長期使用に伴う様々な副作用について十分な理解と対策が不可欠です。
高用量のステロイド薬を継続して使用すると、体重増加や満月様顔貌、中心性肥満などのクッシング症候群様の症状が出現することがあります。
| 副作用 | 早期症状 | 好発時期 |
|---|---|---|
| 骨粗鬆症 | 腰背部痛 | 3-6ヶ月 |
| 糖尿病 | 口渇・多尿 | 1-2ヶ月 |
| 高血圧 | 頭痛・めまい | 2-4週間 |
| 白内障 | 視力低下 | 6-12ヶ月 |
ステロイド薬の長期使用による骨粗鬆症は、特に閉経後の女性や高齢者において骨折のリスクを著しく高めることから、定期的な骨密度測定と予防的な治療介入が大切です。
また、ステロイド誘発性糖尿病の発症リスクは用量依存的に上昇し、糖尿病の家族歴がある患者さんや肥満傾向の方では注意深い血糖値のモニタリングを行います。
免疫抑制薬による副作用
免疫抑制薬の使用に伴う最も深刻な副作用は感染症のリスク上昇であり、日和見感染症への注意が必要です。
シクロホスファミドによる副作用には、骨髄抑制、出血性膀胱炎、悪性腫瘍の発症リスク上昇などがあり、定期的な血液検査や尿検査によるモニタリングが欠かせません。
| 免疫抑制薬 | 主な副作用 | モニタリング項目 |
|---|---|---|
| シクロホスファミド | 骨髄抑制・出血性膀胱炎 | 血算・尿検査 |
| アザチオプリン | 肝障害・骨髄抑制 | 肝機能・血算 |
| メトトレキサート | 間質性肺炎・肝障害 | 胸部X線・肝機能 |
| リツキシマブ | 感染症・アレルギー反応 | 感染症スクリーニング |
長期的な合併症への対応
骨粗鬆症の予防と管理には、カルシウムとビタミンDの十分な摂取に加えて、必要に応じてビスホスホネート製剤などの予防的投与を検討します。
消化性潰瘍の予防には、プロトンポンプ阻害薬やH2受容体拮抗薬の予防投与が推奨され、胃腸症状がある患者さんでは注意深い経過観察が大切になります。
また、感染症予防としてのニューモシスチス肺炎予防薬の投与は、免疫抑制療法中の患者さんにおいて標準的な予防措置です。
保険適用と治療費
以下に記載している治療費(医療費)は目安であり、実際の費用は症状や治療内容、保険適用否により大幅に上回ることがございます。当院では料金に関する以下説明の不備や相違について、一切の責任を負いかねますので、予めご了承ください。
診断時の検査費用について
| 検査項目 | 3割負担時の概算費用 |
|---|---|
| ANCA抗体検査 | 2,000円前後 |
| CT検査 | 6,000~12,000円 |
| MRI検査 | 8,000~15,000円 |
| 組織生検 | 15,000~30,000円 |
寛解導入療法の費用
ステロイドパルス療法は入院治療が基本となり、入院期間中の基本的な治療費用に加えて、薬剤費が発生します。
免疫抑制薬の投与も同時に行われることが多く、使用する薬剤の種類や投与方法によって費用が変動します。
| 薬剤名 | 投与方法 | 費用(3割負担) |
|---|---|---|
| ステロイドパルス療法 | 点滴 | 20,000〜30,000円/コース |
| シクロホスファミド | 点滴/内服 | 10,000〜30,000円/月 |
| リツキシマブ | 点滴 | 150,000〜300,000円/回 |
| プレドニゾロン | 内服 | 2,000〜5,000円/月 |
寛解維持療法の費用
外来での継続治療となる寛解維持療法では、定期的な通院と投薬が必要です。
| 治療薬 | 1か月あたりの概算費用(3割負担) |
|---|---|
| 経口ステロイド薬 | 2,000~5,000円 |
| アザチオプリン | 3,000~8,000円 |
| リツキシマブ | 150,000~300,000円 |
| シクロホスファミド | 10,000~30,000円 |
以上
参考文献
Kitching AR, Anders HJ, Basu N, Brouwer E, Gordon J, Jayne DR, Kullman J, Lyons PA, Merkel PA, Savage CO, Specks U. ANCA-associated vasculitis. Nature reviews Disease primers. 2020 Aug 27;6(1):71.
Yates M, Watts R. ANCA-associated vasculitis. Clinical Medicine. 2017 Feb 1;17(1):60-4.
Geetha D, Jefferson JA. ANCA-associated vasculitis: core curriculum 2020. American Journal of Kidney Diseases. 2020 Jan 1;75(1):124-37.
Jayne DR, Merkel PA, Schall TJ, Bekker P. Avacopan for the treatment of ANCA-associated vasculitis. New England Journal of Medicine. 2021 Feb 18;384(7):599-609.
Pagnoux C. Updates in ANCA-associated vasculitis. European journal of rheumatology. 2016 Sep;3(3):122.
Flossmann O, Berden A, de Groot K, Hagen C, Harper L, Heijl C, Höglund P, Jayne D, Luqmani R, Mahr A, Mukhtyar C. Long-term patient survival in ANCA-associated vasculitis. Annals of the rheumatic diseases. 2011 Mar 1;70(3):488-94.
Nakazawa D, Masuda S, Tomaru U, Ishizu A. Pathogenesis and therapeutic interventions for ANCA-associated vasculitis. Nature Reviews Rheumatology. 2019 Feb;15(2):91-101.
Almaani S, Fussner LA, Brodsky S, Meara AS, Jayne D. ANCA-associated vasculitis: an update. Journal of clinical medicine. 2021 Apr 1;10(7):1446.
Hunter RW, Welsh N, Farrah TE, Gallacher PJ, Dhaun N. ANCA associated vasculitis. Bmj. 2020 Apr 14;369.
Ntatsaki E, Watts RA, Scott DG. Epidemiology of ANCA-associated vasculitis. Rheumatic Disease Clinics. 2010 Aug 1;36(3):447-61.