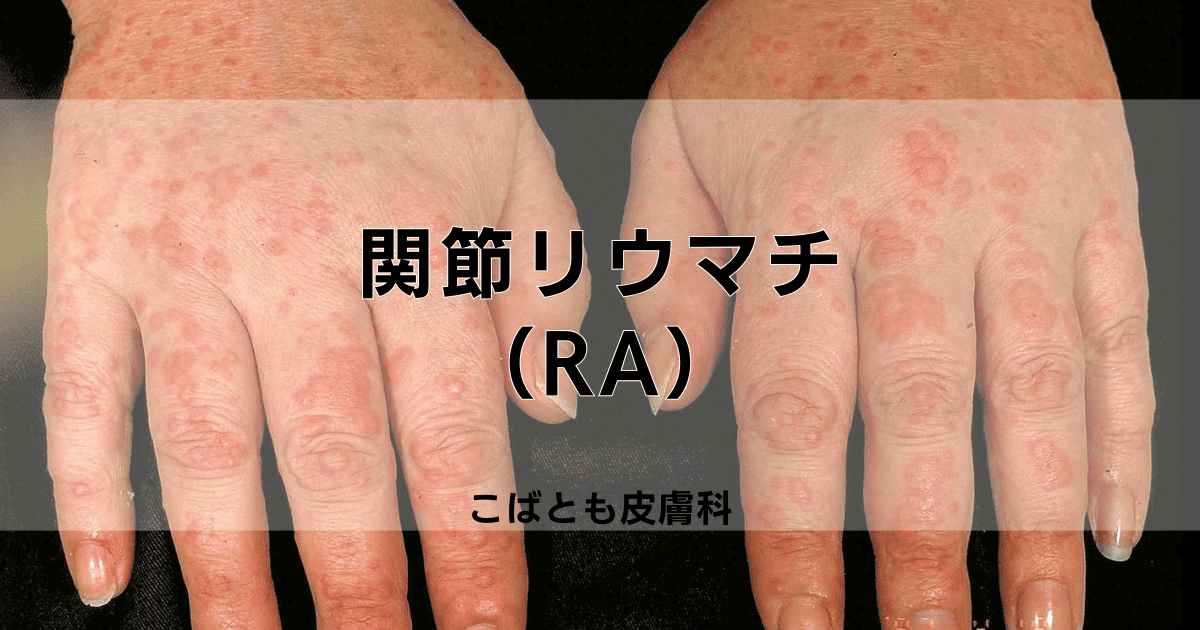
関節リウマチ(RA)(rheumatoid arthritis)とは、免疫システムが自分の体を誤って攻撃してしまう自己免疫疾患で、主に関節に炎症を引き起こす慢性の疾患です。
手指や手首、膝などの関節に左右対称に現れる腫れや痛み、朝方に顕著となる関節のこわばりが特徴的な症状として挙げられ、症状は徐々に進行していきます。
この疾患では、関節を包む滑膜に炎症が起こることで始まり、進行すると軟骨や骨が損傷を受け、最終的には関節の変形や機能障害を起こす可能性があります。
国内の患者数は約80万人と推定されており、30~50代の女性に好発することが知られていますが、性別や年齢に関係なく発症する可能性がある疾患です。
この記事の執筆者

小林 智子(こばやし ともこ)
日本皮膚科学会認定皮膚科専門医・医学博士
こばとも皮膚科院長
2010年に日本医科大学卒業後、名古屋大学医学部皮膚科入局。同大学大学院博士課程修了後、アメリカノースウェスタン大学にて、ポストマスターフェローとして臨床研究に従事。帰国後、同志社大学生命医科学部アンチエイジングリサーチセンターにて、糖化と肌について研究を行う。専門は一般皮膚科、アレルギー、抗加齢、美容皮膚科。雑誌を中心にメディアにも多数出演。著書に『皮膚科医が実践している 極上肌のつくり方』(彩図社)など。
こばとも皮膚科関連医療機関
関節リウマチ(RA)の症状
関節リウマチ(RA)は、手指や手首などの小関節に持続的な腫れや痛みが起こり、進行すると関節の変形や骨破壊を引き起こすだけでなく、全身のさまざまな部位にも多彩な症状が現れます。
関節症状の特徴と進行
関節リウマチにおける関節症状は、朝方に特に強く現れる特徴的な痛みと腫れが両側の手指関節や手首関節に対称的に現れることから始まり、症状は朝のこわばり感として自覚され、症状が重い時期には2時間以上も持続します。
初期の段階では手指の第2関節(PIP関節)や第3関節(DIP関節)、手首の関節に痛みと腫れが集中しやすく、疾患の進行に伴って肘関節、肩関節、膝関節、足関節など、より大きな関節にも症状が広がっていくことが特徴です。
| 好発部位 | 初期症状 | 進行期症状 |
| 手指関節 | 腫れ・痛み | 変形・拘縮 |
| 手首関節 | 可動域制限 | 骨破壊 |
| 膝関節 | 軽度腫脹 | 不安定性 |
| 足関節 | 歩行時痛 | 変形・強直 |
皮膚症状の多様性
関節リウマチに伴う皮膚症状は疾患の活動性を反映する重要な指標となりますが、代表的なリウマトイド結節は、肘や前腕など圧力のかかりやすい部位に発生する皮下の硬い腫瘤として触知できます。
リウマトイド血管炎による皮膚症状は、手指や足趾の先端に潰瘍や壊死を起こすことがあり、症状は爪周囲の毛細血管の異常や皮膚の網状皮斑として観察されることが多く、血管炎の重症度を反映する指標です。
リウマチ性好中球性皮膚症は、発熱を伴って体幹や四肢に無菌性の紅斑や膿疱が多発し、疾患活動性が高まった際に出現しやすい傾向があり、全身性の炎症状態を示唆する重要な所見となります。
壊疽性膿皮症は、急速に拡大する深い潰瘍を形成し、周囲には紫紅色の炎症性発赤が認められるだけでなく、強い疼痛を伴うことが多いです。
全身症状と臓器病変
関節リウマチは全身性の炎症性疾患として知られており、発熱や倦怠感、体重減少などの全身症状が現れることが多く、さらに様々な臓器に症状が及ぶ可能性があり、特に呼吸器系や循環器系への影響が重要視されています。
肺病変としては間質性肺炎や胸膜炎が代表的であり、呼吸困難や乾性咳嗽などの症状として生じます。
心臓では心膜炎や弁膜症を引き起こすことがあり、動悸や息切れの原因となるだけでなく、長期的な心機能への影響も懸念される合併症です。
| 臓器 | 主な症状 | 随伴症状 |
| 肺 | 間質性肺炎 | 呼吸困難 |
| 心臓 | 心膜炎 | 胸痛・動悸 |
| 眼 | 強膜炎 | 充血・痛み |
| 血管 | 血管炎 | 皮膚潰瘍 |
特徴的な神経症状
神経症状は関節リウマチの重要な合併症の一つで、手根管症候群による手指のしびれや痛みが特徴的で、手首の屈筋腱滑膜の炎症により正中神経が圧迫されることで生じる神経障害です。
多発性神経炎による四肢のしびれや筋力低下も見られることがあり、下肢の症状は歩行障害の原因となることが多く、日常生活動作に大きな影響を及ぼします。
頸椎の不安定性による脊髄症状として手足のしびれや筋力低下が現れることがあり、進行すると膀胱直腸障害などの自律神経症状も起き、多岐にわたる症状を起こします。
関節リウマチ(RA)の原因
関節リウマチ(RA)は、遺伝的要因と環境要因が複雑に絡み合っていて、発症メカニズムには様々な因子が関与していることが明らかになっています。
遺伝的要因の影響
遺伝子の個人差は関節リウマチの発症リスクに重要な影響を与えており、免疫系の反応を制御するHLA遺伝子群の中でもHLA-DRB1遺伝子の特定の型を持つ人では、発症リスクが著しく上昇します。
HLA-DRB1遺伝子は、免疫システムにおいて外敵を認識する際に不可欠で、遺伝子の特定の変異が自己免疫反応を引き起こす原因となることが分かってきました。
| 遺伝子型 | 相対リスク |
| HLA-DRB1*04 | 4-5倍 |
| HLA-DRB1*01 | 2-3倍 |
| HLA-DRB1*10 | 3-4倍 |
環境因子の関与
環境要因の中でも特に注目されているのが喫煙で、タバコに含まれる有害物質が肺の組織を傷つけることに対する免疫反応が、関節リウマチの発症につながる可能性があります。
慢性的な歯周病も関節リウマチの発症リスクを高める要因として知られており、口腔内の細菌による持続的な炎症が全身の免疫系に影響を与え、自己免疫反応を促進することが明らかになってきました。
また、大気汚染物質への長期的な曝露は、体内の炎症反応を慢性的に活性化させ、免疫システムの異常をもたらす一因です。
- 喫煙
- 歯周病
- 大気汚染
- ストレス
- ウイルス感染
免疫システムの異常
免疫システムの異常は関節リウマチ発症の主な原因で、通常は外敵から体を守るはずの免疫細胞が、自分自身の組織を誤って攻撃してしまう現象が起こります。
この過程では、T細胞とB細胞という二種類の免疫細胞が重要な役割を果たしており、特にT細胞の過剰な活性化が自己免疫反応の引き金となることが多いです。
活性化されたT細胞は様々な炎症性物質を放出し、関節組織に作用することで炎症が引き起こされ、さらにB細胞も活性化されて自己抗体の産生が促進されます。
リスク要因の相互作用
遺伝的要因と環境要因は独立して存在するのではなく、互いに影響を及ぼし合いながら関節リウマチの発症リスクを高めていくことが分かっています。
特に喫煙者で特定の遺伝子型を持つ人では、それぞれの要因が単独であるる場合と比べて、発症リスクが著しく高いです。
| 要因 | リスク上昇率 |
| 喫煙+遺伝的素因 | 20-40倍 |
| 肥満+遺伝的素因 | 15-25倍 |
| 感染症既往+遺伝的素因 | 10-20倍 |
関節リウマチ(RA)の検査・チェック方法
関節リウマチの診断には、問診や身体診察から始まり、血液検査やレントゲン検査などの各種検査を組み合わせて総合的に判断します。
問診・視診による初期評価
問診では患者さんの症状の経過や生活習慣、家族歴などについて確認し、関節の腫れや痛みの特徴、朝のこわばりの持続時間などを聴取していきます。
視診では、関節の腫れや変形、発赤などの症状を注意深く観察するとともに、関節の動きや圧痛の有無を確認することで、炎症の程度や範囲を評価することが大切です。
問診の項目
- 関節の痛みの性質と部位
- 朝のこわばりの程度と持続時間
- 日常生活での困難な動作
- 症状の進行具合
- 家族歴や生活環境
血液検査による診断
血液検査は関節リウマチの診断において重要な検査で、炎症マーカーや自己抗体の存在を確認することで、病気の活動性や重症度を評価できます。
リウマトイド因子(RF)や抗CCP抗体などの特異的な自己抗体の検査は、関節リウマチの確定診断において高い診断価値を持っており、検査結果は早期診断に大きく貢献します。
| 検査項目 | 基準値 | 陽性時の意味 |
| リウマトイド因子 | 15 IU/mL未満 | 自己免疫反応の存在 |
| 抗CCP抗体 | 4.5 U/mL未満 | 特異的な免疫異常 |
| CRP | 0.3 mg/dL未満 | 炎症の存在 |
| ESR | 20 mm/h未満 | 炎症の程度 |
画像診断による評価
画像診断では、レントゲン検査やMRI、超音波検査などを用いて、関節の状態を詳細に観察します。
- レントゲン検査 骨びらんや関節破壊の程度を評価でき、経時的な変化を追跡することで病気の進行状況を正確に把握すできる。
- MRI検査 早期の炎症や骨の変化を発見するのに優れており、従来のレントゲン検査では見つけにくい初期の病変を検出することが可能。
- 超音波検査 関節の滑膜炎や腱鞘炎などの軟部組織の炎症を、リアルタイムで観察することができ、診断の精度向上に大きく寄与。
総合的な診断評価
| 診断基準項目 | 評価ポイント | スコア |
| 関節腫脹 | 6週間以上持続 | 0-5点 |
| 血清反応 | RF/抗CCP抗体 | 0-3点 |
| 急性期反応 | CRP/ESR | 0-1点 |
| 症状持続期間 | 6週間以上 | 0- |
診断基準に基づいて各検査結果をスコア化し、複数の医学的所見を組み合わせることで、より確実な診断を行うことが可能です。
関節リウマチ(RA)の治療法と治療薬について
関節リウマチの治療には、非ステロイド性抗炎症薬(NSAIDs)による対症療法から始まり、疾患修飾性抗リウマチ薬(DMARDs)や生物学的製剤による本治療まで、症状の進行度に応じて段階的に薬物療法を進めます。
初期治療における薬物選択
関節リウマチの初期治療では、炎症を抑制し痛みを和らげるために、非ステロイド性抗炎症薬(NSAIDs)を中心とした治療を開始します。
非ステロイド性抗炎症薬(NSAIDs)は、関節の腫れや痛みといった症状を迅速に改善し、ステロイド薬は、即効性が高く強力な抗炎症作用を持つことから、症状が重い時期や他の治療薬が効果を発揮するまでの橋渡し的な役割として使用することが多いです。
初期治療で使用される主な薬剤
- ロキソプロフェン
- ジクロフェナク
- セレコキシブ
- プレドニゾロン
- メチルプレドニゾロン
疾患修飾性抗リウマチ薬(DMARDs)による基本治療
| 薬剤名 | 作用機序 | 特徴 |
| メトトレキサート | 葉酸代謝阻害 | 第一選択薬 |
| サラゾスルファピリジン | 免疫調節作用 | 副作用が比較的少ない |
| タクロリムス | カルシニューリン阻害 | 免疫抑制効果が強い |
| イグラチモド | NFκB阻害 | 日本で開発された薬剤 |
疾患修飾性抗リウマチ薬(DMARDs)は、関節リウマチの進行そのものを抑制する効果を持つ薬剤で、早期から使用を開始することで、関節破壊の進行を防げます。
中でもメトトレキサートは、高い有効性と豊富な使用経験から第一選択薬です。
生物学的製剤による先進治療
生物学的製剤は、関節リウマチの炎症に関与する特定の物質を標的として作用する、画期的な治療薬です。
| 薬剤タイプ | 標的分子 | 投与方法 |
| TNF阻害薬 | TNF-α | 皮下注射/点滴 |
| IL-6阻害薬 | IL-6 | 皮下注射/点滴 |
| T細胞制御薬 | CD80/86 | 点滴 |
| B細胞除去薬 | CD20 | 点滴 |
従来の治療薬では十分な効果が得られない患者さんに対して、生物学的製剤は画期的な選択肢です。
最新の生物学的製剤の種類
- TNF阻害薬(アダリムマブ、エタネルセプトなど)
- IL-6阻害薬(トシリズマブなど)
- T細胞制御薬(アバタセプト)
- JAK阻害薬(トファシチニブ、バリシチニブなど)
薬の副作用や治療のデメリットについて
関節リウマチの治療薬は、免疫系に作用して炎症を抑える効果がある一方で、感染症のリスク上昇や各種臓器への悪影響など、さまざまな副作用に注意を払う必要があります。
免疫抑制薬・生物学的製剤の副作用
免疫抑制作用を持つ関節リウマチ治療薬は、細菌やウイルスなどの病原体に対する防御機能も低下させることから、一般的な感染症だけでなく、重篤な日和見感染症を起こすリスクが高まります。
生物学的製剤による治療中は、結核菌の再活性化や重症肺炎のリスクが上昇することから、治療開始前のスクリーニング検査や定期的な胸部レントゲン検査による慎重な経過観察が重要です。
また、これらの薬剤は帯状疱疹ウイルスの再活性化を起こすことがあり、高齢者や基礎疾患を持つ患者さんではより注意深い観察が必要となります。
| 薬剤分類 | 主な副作用 | 感染症リスク |
| 生物学的製剤 | 注射部位反応 | 結核・肺炎 |
| JAK阻害薬 | 帯状疱疹 | 細菌感染症 |
| 免疫抑制薬 | 骨髄抑制 | 日和見感染症 |
| TNF阻害薬 | アレルギー反応 | 真菌感染症 |
ステロイド薬の長期使用に伴うリスク
ステロイド薬の長期使用は、骨粗鬆症や糖尿病、高血圧などの生活習慣病を引き起こすリスクを高めることから、使用量と期間について慎重な判断が求められ、定期的な血糖値や血圧のモニタリングが欠かせません。
骨粗鬆症に関しては、ステロイド薬による骨密度低下が骨折リスクを著しく上昇させることから、カルシウムやビタミンDの補充、さらには骨粗鬆症治療薬の併用が必要となることがあります。
また、ステロイド薬の長期使用は皮膚の脆弱化や創傷治癒の遅延、白内障や緑内障などの眼科的合併症、さらには満月様顔貌などの容貌変化をもたらすことも。
消炎鎮痛薬(NSAIDs)による胃腸障害と腎機能障害
非ステロイド性抗炎症薬(NSAIDs)の継続使用は、胃粘膜の防御機能を低下させることにより、胃潰瘍や十二指腸潰瘍などの消化管障害を引き起こすリスクが高まることから、胃粘膜保護薬を併用します。
また、NSAIDsは腎血流を低下させる作用があり、高齢者や腎機能が低下している患者さんでは、急性腎障害や慢性腎臓病の進行を起こす可能性があることから、定期的な腎機能検査による経過観察が必要です。
| 副作用の種類 | 早期症状 | 要注意の患者背景 |
| 胃潰瘍 | 心窩部痛 | 高齢者・既往歴 |
| 腎機能障害 | 浮腫 | 腎機能低下者 |
| 肝機能障害 | 食欲低下 | 肝疾患合併 |
| 血圧上昇 | 頭痛 | 高血圧症例 |
抗リウマチ薬(DMARDs)特有の副作用
抗リウマチ薬であるメトトレキサートは、肝機能障害や骨髄抑制、間質性肺炎などの重篤な副作用があるので、定期的な血液検査や画像検査によるモニタリングが必須です。
さらに、メトトレキサートは催奇形性を有することから、妊娠可能な女性患者さんにおいては確実な避妊が必要で、妊娠を希望する際には、十分な休薬期間を設けます。
保険適用と治療費
以下に記載している治療費(医療費)は目安であり、実際の費用は症状や治療内容、保険適用否により大幅に上回ることがございます。当院では料金に関する以下説明の不備や相違について、一切の責任を負いかねますので、予めご了承ください。
一般的な投薬治療の費用
薬剤治療では、非ステロイド性抗炎症薬(NSAIDs)、疾患修飾性抗リウマチ薬(DMARDs)、メトトレキサートなどを使用します。
| 治療法 | 月額費用(3割負担) | 年間費用(概算) |
| NSAIDs | 3,000~5,000円 | 36,000~60,000円 |
| DMARDs | 8,000~15,000円 | 96,000~180,000円 |
| ステロイド薬 | 2,000~4,000円 | 24,000~48,000円 |
| 生物学的製剤 | 30,000~50,000円 | 360,000~600,000円 |
定期検査にかかる費用
主な検査項目と頻度
- 血液検査 4~8週間ごと(3,000~5,000円)
- レントゲン検査 3~6ヶ月ごと(1,000~1,500円)
- MRI検査 必要に応じて(15,000~20,000円)
- 超音波検査 症状に応じて(3,000~5,000円)
- 骨密度測定 年1~2回(3,000~5,000円)
リハビリテーションの費用
理学療法や作業療法は、関節機能の維持・改善に大切な役割を担っています。
| リハビリ内容 | 1回あたりの費用 | 推奨頻度 |
| 個別療法 | 3,000~5,000円 | 週1~2回 |
| 集団療法 | 2,000~3,000円 | 週1~2回 |
| 運動指導 | 1,000~2,000円 | 月1~2回 |
以上
参考文献
Radu AF, Bungau SG. Management of rheumatoid arthritis: an overview. Cells. 2021 Oct 23;10(11):2857.
Firestein GS. Evolving concepts of rheumatoid arthritis. Nature. 2003 May 15;423(6937):356-61.
Grassi W, De Angelis R, Lamanna G, Cervini C. The clinical features of rheumatoid arthritis. European journal of radiology. 1998 May 1;27:S18-24.
Gabriel SE. The epidemiology of rheumatoid arthritis. Rheumatic disease clinics of north America. 2001 May 1;27(2):269-81.
Scott DL, Huskisson EC. The course of rheumatoid arthritis. Baillière’s clinical rheumatology. 1992 Feb 1;6(1):1-21.
Aletaha D, Smolen JS. Diagnosis and management of rheumatoid arthritis: a review. Jama. 2018 Oct 2;320(13):1360-72.
American College of Rheumatology Subcommittee on Rheumatoid Arthritis Guidelines. Guidelines for the management of rheumatoid arthritis: 2002 update. Arthritis & Rheumatism. 2002 Feb;46(2):328-46.
Smolen JS, Steiner G. Therapeutic strategies for rheumatoid arthritis. Nature reviews Drug discovery. 2003 Jun 1;2(6):473-88.
Weyand CM, Goronzy JJ. The immunology of rheumatoid arthritis. Nature immunology. 2021 Jan;22(1):10-8.
McInnes IB, O’Dell JR. State-of-the-art: rheumatoid arthritis. Annals of the rheumatic diseases. 2010 Nov 1;69(11):1898-906.