ポルフィリン症(porphyria)とは、体内でヘムを合成する過程において特定の酵素が正常に機能せず、代謝異常をきたす遺伝性疾患です。
ヘムは赤血球のヘモグロビンを構成する重要な要素であり、全身の細胞でエネルギー産生に関与する不可欠な物質ですが、この疾患では生合成過程に支障をきたします。
ヘム合成に関与する8種類の酵素のいずれかに機能異常が生じることで、中間生成物であるポルフィリンやその前駆体が体内に過剰に蓄積し、様々な症状を起こします。
この記事の執筆者

小林 智子(こばやし ともこ)
日本皮膚科学会認定皮膚科専門医・医学博士
こばとも皮膚科院長
2010年に日本医科大学卒業後、名古屋大学医学部皮膚科入局。同大学大学院博士課程修了後、アメリカノースウェスタン大学にて、ポストマスターフェローとして臨床研究に従事。帰国後、同志社大学生命医科学部アンチエイジングリサーチセンターにて、糖化と肌について研究を行う。専門は一般皮膚科、アレルギー、抗加齢、美容皮膚科。雑誌を中心にメディアにも多数出演。著書に『皮膚科医が実践している 極上肌のつくり方』(彩図社)など。
こばとも皮膚科関連医療機関
ポルフィリン症の病型
ポルフィリン症は、急性ポルフィリン症と皮膚ポルフィリン症の2つの主要な病型に大別することができ、それぞれの病型には複数の亜型があります。
急性ポルフィリン症の概要と分類
急性ポルフィリン症は、ヘム合成経路における酵素の遺伝的な変異によって起き、急性発作を特徴とします。
急性ポルフィリン症には、急性間欠性ポルフィリン症(AIP)、遺伝性コプロポルフィリン症(HCP)、異型ポルフィリン症(VP)という3つの亜型が存在します。
亜型は、それぞれ異なる遺伝子の変異によって生じるものの、臨床症状や生化学的特徴において類似点が多いことが、研究によって解明されてきました。
| 急性ポルフィリン症の亜型 | 欠損酵素 | 遺伝形式 |
|---|---|---|
| 急性間欠性ポルフィリン症 | HMBS | 常染色体優性 |
| 遺伝性コプロポルフィリン症 | CPOX | 常染色体優性 |
| 異型ポルフィリン症 | PPOX | 常染色体優性 |
皮膚ポルフィリン症の特徴と分類体系
皮膚ポルフィリン症は、光線過敏症状を主体とする病型であり、日光暴露による皮膚症状が特徴的な疾患グループとして分類されています。
皮膚ポルフィリン症の代表的な亜型として、晩発性皮膚ポルフィリン症(PCT)、先天性赤芽球性ポルフィリン症(CEP)、赤血球性プロトポルフィリン症(EPP)などが知られており、それぞれが独自の遺伝的背景と臨床的特徴を持っています。
皮膚ポルフィリン症の各亜型は、ポルフィリン代謝経路における特定の酵素欠損によって特徴づけられ、欠損部位によって臨床症状の違いが生じるのです。
| 皮膚ポルフィリン症の亜型 | 欠損酵素 | 主な症状部位 |
|---|---|---|
| 晩発性皮膚ポルフィリン症 | UROD | 露光部 |
| 先天性赤芽球性ポルフィリン症 | UROS | 全身 |
| 赤血球性プロトポルフィリン症 | FECH | 露光部 |
ポルフィリン症の症状
ポルフィリン症では、体内のヘム合成経路の異常により、神経症状、消化器症状、皮膚症状など、全身にわたる多様な症状が現れます。
急性ポルフィリン症の主要症状
急性ポルフィリン症の最も重要な特徴は、激しい腹痛や全身の神経症状が発作的に起こることで、症状は数日から数週間持続すします。
急性発作時には、強い腹痛に加えて、吐き気や嘔吐、便秘などの消化器症状が出現し、また、手足のしびれや筋力低下、意識レベルの変化、不安や興奮などの精神症状も見られます。
| 症状の分類 | 主な症状 | 特徴的な所見 |
|---|---|---|
| 消化器症状 | 腹痛、嘔吐、便秘 | 発作性の激痛 |
| 神経症状 | 四肢のしびれ、筋力低下 | 対称性の症状 |
| 精神症状 | 不安、興奮、うつ状態 | 急性期に増悪 |
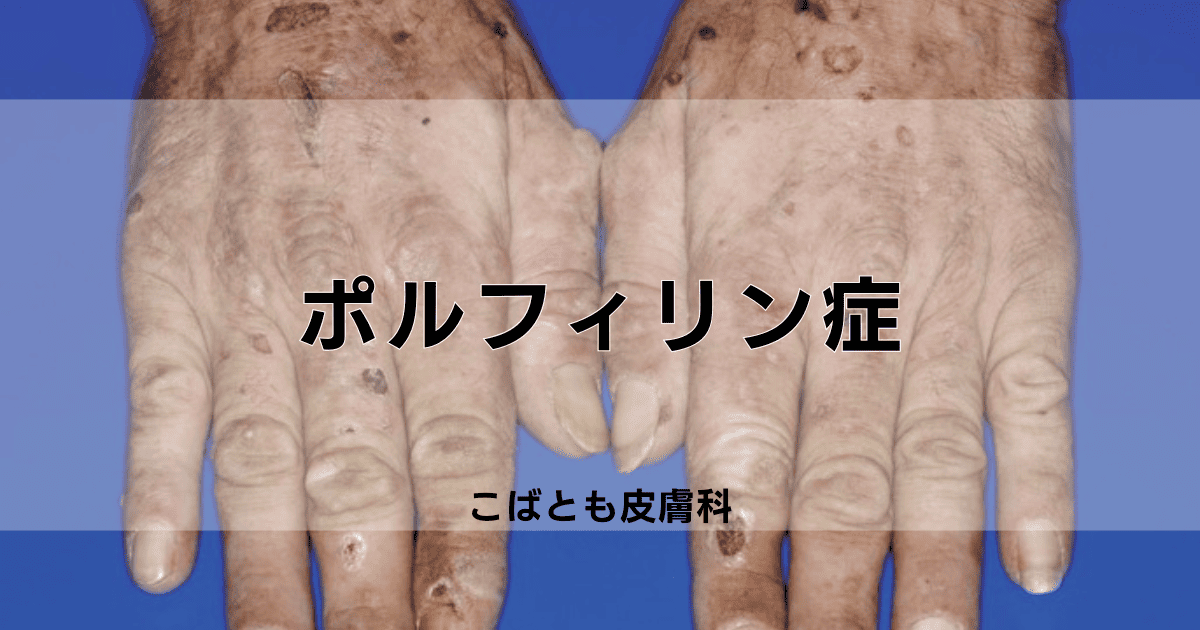
皮膚症状の特徴
光線過敏性のポルフィリン症では、日光暴露により皮膚に特徴的な症状が現れ、その程度は季節や活動時間帯によって変動することが特徴です。
日光に当たった部位に、痛みを伴う水疱や潰瘍が形成され、症状は顔面や手背などの露出部位に好発し、慢性的な日光暴露は、皮膚の肥厚や瘢痕形成を起こし、露出部位の永続的な変化をもたらすことがあります。
- 急性の皮膚症状 灼熱感、痛み、掻痒感、紅斑、水疱形成
- 慢性の皮膚変化 色素沈着、瘢痕形成、皮膚の肥厚化、脆弱性亢進
- 好発部位 顔面、手背、前腕、下腿など日光露出部位
- 増悪因子 紫外線暴露、外傷、感染、ストレス
全身症状と随伴症状
ポルフィリン症では、全身の様々な臓器に症状が及び、複数の症状が同時に現れることで患者さんの体調に複合的な影響を与えます。
急性発作時には、頻脈や血圧上昇などの自律神経症状が生じ、全身状態の悪化を示す重要なサインです。
| 影響を受ける系統 | 代表的な症状 | 発現頻度 |
|---|---|---|
| 自律神経系 | 頻脈、発汗、血圧変動 | 高頻度 |
| 中枢神経系 | 痙攣、意識障害 | 中等度 |
| 末梢神経系 | 感覚障害、運動障害 | 高頻度 |
症状の経過と特徴的なパターン
ポルフィリン症の症状は、急性発作型と慢性進行型の二つの大きなパターンがあり、急性発作型では、誘因となる要素への暴露により突然症状が出現し、対応がなければ重症化します。
慢性進行型では、緩やかに進行する皮膚症状や神経症状が中心となり、症状は季節によって変動します。
- 急性発作型の特徴 突然の症状出現、重症度の変動、複数症状の組み合わせ
- 慢性進行型の特徴 緩徐な進行、皮膚症状優位、季節性変動
- 共通する特徴 症状の多様性、個人差の存在、環境因子の影響
- 経過観察のポイント 症状の変化、誘因の特定、生活環境との関連
全身性の代謝異常を背景とするポルフィリン症では、症状の組み合わせや重症度が個々の患者さんによって大きく異なることに注意が必要です。
ポルフィリン症の原因
ポルフィリン症は、ヘム合成経路における特定の酵素の遺伝的欠損や活性低下によって起こり、発症には遺伝的要因と環境因子が複雑に関与しています。
遺伝的要因とヘム合成経路の異常
ポルフィリン症の根本的な原因は、ヘム合成に関与する8つの酵素のいずれかに遺伝子変異が生じることによって、ヘムの生合成過程に障害が起こることです。
ヘム合成経路における酵素の遺伝子変異は、常染色体優性遺伝や常染色体劣性遺伝のパターンを示すことが、明らかにされていて、遺伝子変異は、家系内で世代を超えて受け継がれていくことがあります。
| 酵素名 | 遺伝子座 | 遺伝形式 | 関連する病型 |
|---|---|---|---|
| ALAD | 9q34 | 劣性 | ALA脱水素酵素欠損性ポルフィリン症 |
| HMBS | 11q23.3 | 優性 | 急性間欠性ポルフィリン症 |
| UROS | 10q26.2 | 劣性 | 先天性赤芽球性ポルフィリン症 |
遺伝子変異による影響
- 特定の酵素活性が著しく低下する
- ポルフィリン前駆体が過剰に蓄積する
- 組織特異的な発現パターンを示す
- 年齢依存的に症状が進行することがある
環境因子と誘発要因の関連性
環境因子の影響は、遺伝的背景と相互作用しながら、ヘム合成経路のバランスを崩すことで、疾患の発症や増悪に関与することが、解明されてきました。
特に薬物や化学物質への曝露、ホルモンバランスの変化、栄養状態の変動などが、代謝経路に影響を与える主要な因子です。
| 環境因子 | 作用機序 | 影響を受ける酵素 |
|---|---|---|
| 薬物 | 代謝酵素誘導 | ALAS1 |
| ホルモン | 転写調節 | HMBS |
| 栄養状態 | 補酵素活性 | 複数 |
環境因子による影響の特徴
- 個人差が大きい
- 曝露量と症状の重症度に相関がある
- 複数の因子が同時に作用することがある
- 季節性の変動を示すことがある
分子レベルでの発症メカニズム
ポルフィリン症における分子レベルでの病態は、ヘム合成経路の特定のステップでの酵素活性低下から始まり、中間代謝産物の蓄積や代償性の代謝変動が起ります。
遺伝子変異により影響を受けた酵素の機能低下は、中間代謝産物の蓄積を生じさせ、これらの物質が直接的または間接的に組織障害を起こすことが明らかになってきました。
特に、ミトコンドリアや細胞質での代謝バランスの崩れが、酸化ストレスの増加や細胞機能の障害につながります。
遺伝子発現調節と代謝制御の異常
ポルフィリン症における遺伝子発現の調節異常は、単なる酵素活性の低下だけでなく、代謝ネットワーク全体に影響を及ぼすことが、解明されてきました。
遺伝子発現の変化は、組織特異的な転写因子の作用や、エピジェネティックな制御機構の変調を通じて、様々な代謝経路に波及的な影響を与えます。
特に、核内受容体を介した転写制御の異常が、ヘム合成経路の恒常性維持に重大な影響を与えることが、最新の研究により明らかになってきています。
ポルフィリン症の検査・チェック方法
ポルフィリン症の診断では、臨床症状の確認に加え、尿中・血中・便中のポルフィリンおよび前駆体の測定、遺伝子検査による確定診断など、複数の検査を組み合わせて総合的に判断します。
初期評価と問診のポイント
問診では、症状の発症時期や進行パターン、誘因となる可能性のある環境要因や生活習慣の変化について、詳細な情報収集を行います。
家族歴の聴取は診断の手がかりとして不可欠であり、血縁者における類似症状の有無や遺伝性疾患の既往について、注意深く確認することが大切です。
皮膚症状がある場合には、日光暴露との関連性や季節変動について、患者さんの生活パターンと照らし合わせながら詳しく評価していきます。
| 問診項目 | 確認ポイント | 診断的意義 |
|---|---|---|
| 症状の特徴 | 発症時期、進行速度 | 病型分類 |
| 環境因子 | 職業、生活環境 | 誘因特定 |
| 家族歴 | 血縁者の症状 | 遺伝性評価 |
生化学的検査による診断
尿中ポルフィリン体検査は最も基本的なスクリーニング検査であり、24時間蓄尿による定量的評価を行うことで、病型の推定に役立つ情報が得られます。
血液検査では、末梢血一般検査に加えて、肝機能検査や腎機能検査など、全身状態の評価に必要な項目を確認します。
便中ポルフィリン検査は、皮膚症状主体の病型で診断的価値が高く、ポルフィリン症の病型分類において重要な判断材料です。
- 尿中検査項目 ALA、PBG、ウロポルフィリン、コプロポルフィリン
- 血液検査項目 血算、肝機能、腎機能、電解質
- 便中検査項目 総ポルフィリン量、分画定量
- 特殊検査 赤血球プロトポルフィリン、血漿ポルフィリン
遺伝子検査による確定診断
遺伝子検査は、ポルフィリン症の確定診断において最も確実な方法であり、ヘム合成経路に関与する各種酵素の遺伝子変異を同定する方法です。
| 検査種類 | 検査対象 | 特徴 |
|---|---|---|
| 遺伝子解析 | 酵素遺伝子 | 確定診断 |
| 酵素活性測定 | 赤血球・リンパ球 | 機能評価 |
| 家系調査 | 血縁者 | 遺伝形式確認 |
補助的検査と経過観察
神経症状が疑われる場合には、神経伝導検査や筋電図検査などの神経生理学的検査を実施し、末梢神経障害の程度や分布を評価します。
皮膚症状の評価には、必要に応じて皮膚生検や光線過敏試験を実施し、組織学的な変化や光線感受性を詳細に調べます。
- 神経生理学的検査 神経伝導速度、筋電図、脳波
- 皮膚検査 生検、光線過敏試験、蛍光顕微鏡検査
- 画像検査 腹部超音波、MRI、CT
- 心機能検査 心電図、心エコー
定期的な検査により、症状の進行状況や合併症の有無を継続的にモニタリングすることで、早期の異常発見が可能です。
ポルフィリン症の治療法と治療薬について
ポルフィリン症の治療においては、ヘムアルギネート製剤による点滴静注療法を中心に、各病型に応じた特異的な治療薬の投与と長期的なフォローアップが必要です。
急性発作時の治療戦略
急性ポルフィリン症の発作時には、ヘムアルギネート製剤の迅速な投与が症状の改善において重要な役割を果たすことが多いです。
ヘムアルギネート製剤は、神経症状の進行を防ぎ早期の回復を促進することが、治療ガイドラインでも推奨されていて、1日1回、3〜4mg/kgを4日間連続で静脈内投与することで、急性症状の緩和と再発予防に高い効果を示します。
| 治療薬 | 投与量 | 投与期間 | 主な副作用 |
|---|---|---|---|
| ヘムアルギネート | 3-4mg/kg/日 | 4日間 | 静脈炎 |
| グルコース | 300-500g/日 | 発作中 | 高血糖 |
| 鎮痛薬 | 症状に応じて | 必要時 | 胃部不快感 |
急性期の治療における注意点
- 迅速な治療開始が予後を左右
- 疼痛コントロールが不可欠
- 電解質バランスの維持に留意
- 薬物相互作用に注意が必要
皮膚症状に対する治療アプローチ
皮膚ポルフィリン症に対しては、紫外線防御を基本としながら、病型特異的な薬物療法を組み合わせることで、より効果的な治療効果が得られることが明らかになっています。
クロロキンやヒドロキシクロロキンなどの抗マラリア薬は、晩発性皮膚ポルフィリン症において高い治療効果を示し、薬剤は、肝臓でのポルフィリン代謝を改善し、皮膚症状の軽減に寄与するのです。
| 治療薬 | 作用機序 | 投与期間 | 効果発現時期 |
|---|---|---|---|
| クロロキン | 代謝改善 | 6-12ヶ月 | 2-3ヶ月 |
| ヒドロキシクロロキン | 代謝改善 | 6-12ヶ月 | 2-3ヶ月 |
| β-カロテン | 光防御 | 継続 | 2-4週間 |
皮膚症状治療の主なポイント
- 長期的な治療継続が必要である
- 定期的な肝機能モニタリングを行う
- 薬剤の用量調整を慎重に行う
- 治療効果の評価を定期的に実施する
薬の副作用や治療のデメリットについて
ポルフィリン症の治療では、使用する薬剤によって様々な副作用やリスクが発生することがあり、ヘムアルギネート製剤による静脈炎や抗マラリア薬による網膜症などが重要な注意点です。
主要な治療薬による副作用
ヘムアルギネート製剤の投与においては、静脈炎や血管痛などの局所的な副作用が比較的高頻度で発生することが多いです。
静脈炎の発生リスクを低減するためには、薬液の希釈度や投与速度の調整が不可欠で、場合によっては中心静脈カテーテルの使用を検討し、長期的な投与では鉄過剰症のリスクが増加します。
| 治療薬 | 主な副作用 | 発現頻度 | モニタリング項目 |
|---|---|---|---|
| ヘムアルギネート | 静脈炎、血管痛 | 高頻度 | 注射部位状態 |
| クロロキン | 網膜症、消化器症状 | 中頻度 | 眼科検査 |
| ヒドロキシクロロキン | 皮膚症状、頭痛 | 低頻度 | 皮膚状態 |
ヘムアルギネート製剤投与時の注意点
- 投与速度の厳密な管理が必要である
- 末梢静脈の状態を継続的に観察する
- 投与部位の定期的な変更を行う
- 血管外漏出に十分注意する
抗マラリア薬関連の合併症
抗マラリア薬による治療では、網膜症のリスクが最も深刻な副作用で、投与量や投与期間に応じて発生率が上昇するので注意が必要です。
クロロキンやヒドロキシクロロキンの長期投与では、定期的な眼科検査による網膜の状態評価が極めて大切で、また、消化器症状や皮膚症状などの比較的軽度の副作用も高頻度で生じます。
| 副作用 | 発現時期 | 予防措置 | 対処法 |
|---|---|---|---|
| 網膜症 | 長期投与後 | 定期検査 | 投与中止 |
| 消化器症状 | 投与初期 | 食後投与 | 制吐剤使用 |
| 皮膚症状 | 不定期 | 観察強化 | 投与調整 |
抗マラリア薬の副作用モニタリング
- 網膜機能検査を定期的に実施
- 視力や視野の変化に注意
- 皮膚症状の出現を観察
- 消化器症状の程度を評価
保険適用と治療費
以下に記載している治療費(医療費)は目安であり、実際の費用は症状や治療内容、保険適用否により大幅に上回ることがございます。当院では料金に関する以下説明の不備や相違について、一切の責任を負いかねますので、予めご了承ください。
診断時の検査費用
診断時には、遺伝子検査、尿中・血中・便中のポルフィリン検査などを行います。
| 検査項目 | 自己負担額(3割負担の場合) |
|---|---|
| 遺伝子検査 | 15,000円程度 |
| 尿中ポルフィリン | 3,000円程度 |
| 血液生化学検査 | 2,500円程度 |
| 便中ポルフィリン | 3,500円程度 |
薬物療法にかかる費用
主な薬剤費用(3割負担の場合)
ヘム製剤(ノルモサング®)
- 1回の投与あたり 約15,000〜20,000円
- 急性発作時は通常4日間連続投与が必要で、1クールあたり60,000〜80,000円程度
グルコース大量療法
- 10%ブドウ糖液(500mL) 約300円/本
- 急性発作時は1日複数本必要で、1クールの治療で3,000〜5,000円程度
鎮痛剤・制吐剤
- オピオイド系鎮痛薬 2,000〜4,000円/日
- 制吐剤 1,000〜2,000円/日
予防的服薬
- ビタミンC製剤 月額1,000〜2,000円
- βカロテン製剤 月額2,000〜3,000円
入院治療における費用
急性発作時の入院では、症状の程度や入院期間によって費用が変動します。
| 治療内容 | 平均入院期間 | 概算費用(3割負担) |
|---|---|---|
| 一般病棟入院 | 7-14日 | 15-30万円 |
| ICU入院 | 3-7日 | 30-50万円 |
| 一般外来治療 | – | 1-3万円/月 |
定期的なモニタリング費用
長期的な経過観察に必要な検査費用
- 血液検査(月1回) 4,000円程度
- 尿検査(月1回) 2,000円程度
- 画像検査(年2回) 8,000円程度
- 神経学的検査(必要時) 5,000円程度
以上
参考文献
Thadani H, Deacon A, Peters T. Diagnosis and management of porphyria. Bmj. 2000 Jun 17;320(7250):1647-51.
Puy H, Gouya L, Deybach JC. Porphyrias. The Lancet. 2010 Mar 13;375(9718):924-37.
Elder GH. Porphyria cutanea tarda. InSeminars in liver disease 1998 (Vol. 18, No. 01, pp. 67-75). © 1998 by Thieme Medical Publishers, Inc..
Edel Y, Mamet R. Porphyria: what is it and who should be evaluated?. Rambam Maimonides medical journal. 2018 Apr;9(2).
Schmid R, Findlay CB. Porphyria. The American Journal of Nursing. 1952 Oct 1:1249-51.
Pischik E, Kauppinen R. An update of clinical management of acute intermittent porphyria. The application of clinical genetics. 2015 Sep 1:201-14.
Herrick AL, McColl KE. Acute intermittent porphyria. Best practice & research Clinical gastroenterology. 2005 Apr 1;19(2):235-49.
Ramanujam VM, Anderson KE. Porphyria diagnostics—part 1: a brief overview of the porphyrias. Current protocols in human genetics. 2015 Jul;86(1):17-20.
Kauppinen R. Porphyrias. The Lancet. 2005 Jan 15;365(9455):241-52.
Fritsch C, Bolsen K, Ruzicka T, Goerz G. Congenital erythropoietic porphyria. Journal of the American Academy of Dermatology. 1997 Apr 1;36(4):594-610.